Researchers have investigated for the first time how two different forms of вода (ortho- and para-) behave differently when undergoing chemical reactions.
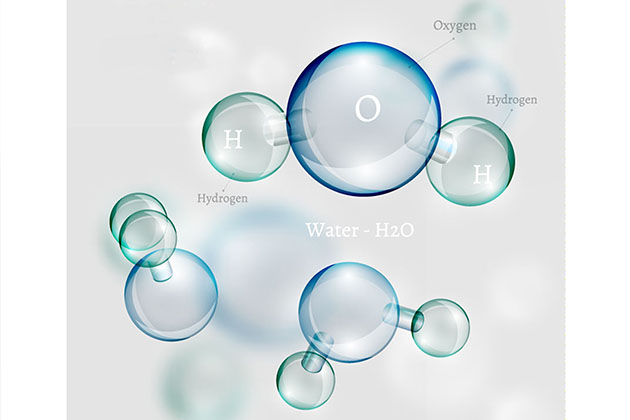
Вода is a chemical entity, a molecule in which a single кислород atom is linked to two hydrogen atoms (H2O). Вода exists as liquid, solid (ice) and gas (vapours). It is among the few chemicals which do not contain въглероден and still can be liquid at room temperature (about 20 degrees). Вода is ubiquitous and important for life. At the molecular level it is well known that everyday вода exists in two different forms but this information is not of common knowledge. These two forms of вода are called isomers and are referred to as ortho- or para- вода. The main difference between these forms is very subtle and is simply the relative orientation of the nuclear spins of the two hydrogen atoms which are aligned in either same or opposite direction, hence their names. This spin of hydrogen atoms is due to atomic physics though this phenomenon is not yet fully understood. These two forms have identical physical properties and it has been believed so far that they should also then have identical chemical properties.
В скорошно проучване, публикувано в природа Communications, researchers from the University of Basel, Hamburg have for the first time investigated the difference in chemical reactivity of these two forms of вода and have proven that ortho- and para- forms react very differently. Chemical reactivity means the way or the ability by which a molecule undergoes a chemical reaction. The study involved separation of вода into its two isomeric forms (ortho- and para-) using an electrostatic deflector by involving electric fields. Since both these isomers are practically the same and have identical physical properties, this separation process is complex and challenging. The separation was achieved by this group of researchers by using a method based of electric fields developed by them for Free-Electron Laser Science. The deflector introduces an electric field to a beam of atomized water. Since there is crucial difference in nuclear spin in the two isomers, this slightly impacts the way by which atoms interact with this electric field. Therefore, as the water travels through the deflector it starts separating into its two forms ortho- and para-.
Researchers have demonstrated that para- вода reacts around 25 percent faster than ortho-water and its able to attract to a реакция партньор по-силно. Това определено се обяснява с разликата в ядрения спин, който влияе върху въртенето на водните молекули. Освен това електрическото поле на параводата е в състояние да привлече йоните по-бързо. Освен това групата извърши компютърни симулации на водни молекули, за да потвърди своите открития. Всички експерименти са направени с молекули при много ниски температури почти -273 градуса по Целзий. Това е важен фактор, както обясняват авторите, че само при такива условия отделните квантови състояния и енергийното съдържание на молекулите могат да бъдат добре дефинирани и по-добре контролирани. Което означава, че водната молекула се стабилизира като една от двете си форми и техните разлики стават очевидни и ясни. По този начин, изследването на химичните реакции може да разкрие основните механизми и динамика, водещи до по-добро разбиране. Въпреки това, практическата употреба на това изследване може да не е много висока в момента.
***
{Можете да прочетете оригиналната изследователска статия, като щракнете върху връзката DOI, дадена по-долу в списъка с цитирани източници}
Източник (и)
Kilaj A et al 2018. Наблюдение на различни реактивности на пара и орто-вода към уловени диазенилиеви йони. Nature съобщенията. 9 (1). https://doi.org/10.1038/s41467-018-04483-3