Rezdiffra (resmetirom) е одобрен от FDA на САЩ за лечение на възрастни с нециротичен неалкохолен стеатохепатит (NASH) с умерени до напреднали чернодробни белези (фиброза), за да се използва заедно с диета и упражнения.
Досега пациентите с нецирозен неалкохолен стеатохепатит (NASH), които също имат забележими чернодробни белези, не са имали лекарство, което може директно да се справи с увреждане на черния дроб. FDA одобрението на Rezdiffra за първи път ще предостави a лечение опция за тези пациенти, в допълнение към диета и упражнения.
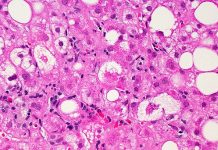
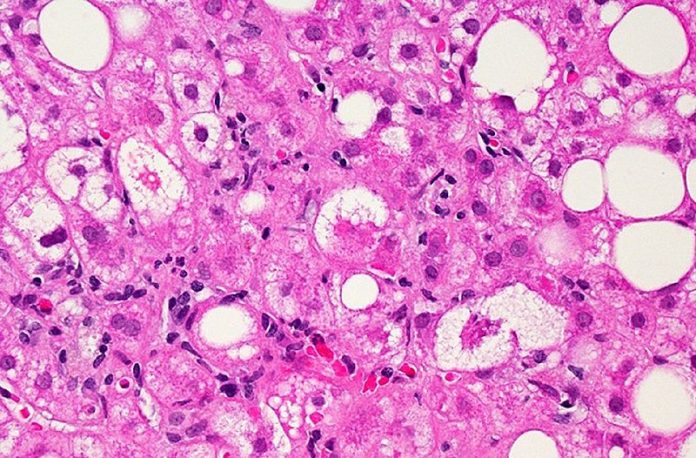
NASH е резултат от прогресията на неалкохолната мастна тъкан черен дроб болест където черен дроб възпалението с течение на времето може да доведе до чернодробни белези и чернодробна дисфункция. NASH често се свързва с други здравословни проблеми като високо кръвно налягане и диабет тип 2. Според поне една оценка приблизително 6-8 милиона души в САЩ имат NASH с умерени до напреднали чернодробни белези, като този брой се очаква да нарасне.
Rezdiffra е частичен активатор на рецептор на тиреоиден хормон; активирането на този рецептор от Rezdiffra в черния дроб намалява натрупването на мазнини в черния дроб.
Безопасност и ефикасност на Rezdiffra
Безопасността и ефикасността на Rezdiffra е оценена въз основа на анализ на сурогатна крайна точка на 12-ия месец в 54-месечно, рандомизирано, двойно-сляпо, плацебо-контролирано изпитване. Сурогатната крайна точка измерва степента на черен дроб възпаление и белези. От спонсора се изисква да проведе проучване след одобрението, за да потвърди и опише клиничната полза от Rezdiffra, което ще бъде направено чрез завършване на същото 54-месечно проучване, което все още продължава. За да се включат в изпитването, пациентите трябваше да имат a черен дроб биопсия, показваща възпаление, дължащо се на NASH с умерена или напреднала форма черен дроб белези. В проучването 888 субекта бяха разпределени на случаен принцип да получат едно от следните: плацебо (294 субекта); 80 милиграма Rezdiffra (298 субекта); или 100 милиграма Rezdiffra (296 субекта); веднъж дневно, в допълнение към стандартните грижи за NASH, които включват консултации за здравословна диета и упражнения.
След 12 месеца чернодробните биопсии показват, че по-голяма част от пациентите, лекувани с Rezdiffra, са постигнали отзвучаване на NASH или подобрение на чернодробните белези в сравнение с тези, които са получавали плацебо. Общо 26% до 27% от субектите, които са получили 80 милиграма Rezdiffra и 24% до 36% от субектите, които са получили 100 милиграма Rezdiffra, са имали отзвучаване на NASH и липса на влошаване на чернодробните белези, в сравнение с 9% до 13% от тези, които получи плацебо и консултиране относно диета и упражнения. Диапазонът от отговори отразява различните показания на патолозите. В допълнение, общо 23% от пациентите, които са получили 80 милиграма Rezdiffra и 24% до 28% от пациентите, които са получили 100 милиграма Rezdiffra, са имали подобрение на черен дроб белези и липса на влошаване на NASH, в сравнение с 13% до 15% от тези, които са получили плацебо, в зависимост от показанията на всеки патолог. Демонстрацията на тези промени при част от пациентите само след една година лечение е забележима, тъй като болест обикновено прогресира бавно, като на повечето пациенти са необходими години или дори десетилетия, за да се покаже прогресия.
Странични ефекти на Rezdiffra
Най-честите нежелани реакции на Rezdiffra включват диария и гадене. Rezdiffra идва с определени предупреждения и предпазни мерки, като индуцирана от лекарства чернодробна токсичност и странични ефекти, свързани с жлъчния мехур.
Употребата на Rezdiffra трябва да се избягва при пациенти с декомпенсирана цироза. Пациентите трябва да спрат да използват Rezdiffra, ако развият признаци или симптоми на влошаване черен дроб функционират по време на лечение с Rezdiffra.
Лекарствени взаимодействия на Rezdiffra
Употребата на Rezdiffra едновременно с някои други лекарства, по-специално статини за понижаване на холестерола, може да доведе до потенциално значими лекарствени взаимодействия. Доставчиците на здравни услуги трябва да направят справка с пълната информация за предписване за допълнителна информация относно тези потенциално значими лекарствени взаимодействия с Rezdiffra, препоръчителната доза и промени в приложението.
- FDA одобрен Rezdiffra по ускорения път на одобрение, който позволява по-ранно одобрение на лекарства, които лекуват сериозни състояния и адресират неудовлетворена медицинска нужда, въз основа на сурогатна или междинна клинична крайна точка, която е разумно вероятно да предскаже клинична полза. Изискваното гореспоменато 54-месечно проучване, което продължава, ще оцени клиничната полза след 54 месеца лечение с Rezdiffra.
Rezdiffra получи обозначения като Breakthrough Therapy, Fast Track и Priority Review за това показание.
- FDA даде одобрението на Rezdiffra на Madrigal Pharmaceuticals.
***
Източник:
FDA 2024. Съобщение за новини – FDA одобрява първото лечение за пациенти с чернодробни белези, дължащи се на мастно чернодробно заболяване. Публикувано на 14 март 2024 г. Достъпно на https://www.fda.gov/news-events/press-announcements/fda-approves-first-treatment-patients-liver-scarring-due-fatty-liver-disease
***